RESUMEN
La enfermedad de Chagas constituye una infección severa de alta prevalencia en Argentina y otros países latinoamericanos. La administración de drogas reumáticas inmunosupresoras en estos pacientes, muchas veces es necesaria, pero no se conoce aún la implicancia que esto puede tener en la reactivación de la enfermedad de Chagas. En esta puesta al día se revisan criterios generales de diagnóstico en este grupo de pacientes y las recomendaciones realizadas al respecto.
Enfermedad de Chagas e infección por Chagas
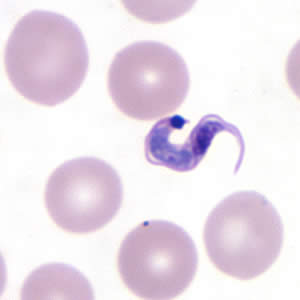
La enfermedad de Chagas, causada por un parásito, el Trypanosoma cruzi, afecta aproximadamente a 10 millones de personas en el mundo, especialmente en Sudamérica. Basado en datos de la OMS1 [Organización Mundial de la Salud (OMS) Control y Prevención de Chagas en América (2015)], Argentina es el país con más pacientes afectados en todo el mundo (1.500.000 personas infectadas), siendo la prevalencia de esta enfermedad de casi el 3%. Más de 100 años después de su descubrimiento, la enfermedad de Chagas continúa siendo un reto para los profesionales de la salud. La enfermedad se caracteriza por una fase aguda, generalmente asintomática (solo el 10% tiene síntomas) que presenta parasitemia positiva. La fase crónica ocurre aproximadamente 1-2 meses después de la infección; durante la misma, la mayor parte de los pacientes están asintomáticos, tienen parasitemias fluctuantes, lo que se conoce como forma indeterminada. Sin embargo, un porcentaje variable de pacientes desarrollan complicaciones décadas después de la infección (10 a 30 años después), siendo sintomática en un 20-30% de los casos predominantemente con afectación cardíaca, digestiva o mixta. La afección más frecuente es la cardíaca, detectable de forma clínica y con estudios convencionales (electrocardiograma, ecografía y radiografía de tórax), pero puede afectar otros aparatos/órganos, como se esquematiza en la Tabla 1. La enfermedad crónica tiene estadios según grado de compromiso visceral y complicación clínica3 : En el nivel A, están los pacientes sin síntomas presentes de Insuficiencia cardíaca (IC) y sin cardiopatía estructural (ECG y Rx de tórax normales). Mientras el paciente permanece con esa forma de la enfermedad, su pronóstico no es comprometido. En el nivel B, están los pacientes con cardiopatía estructural pero que nunca tuvieron señales ni síntomas de IC. Ese nivel se divide en: B1 Pacientes con alteraciones electrocardiográficas (trastornos de conducción o arritmias), pudiendo presentar alteraciones ecocardiográficas discretas (anormalidades de la contractilidad regional), sin embargo la función ventricular global es normal. B2 Pacientes con disfunción ventricular global (fracción de eyección del VI reducida). En el nivel C, están los pacientes con disfunción del VI y síntomas previos o actuales de IC (NYHA I, II, III y IV). En el nivel D, se encuentran los pacientes con síntomas de IC en reposo, refractarios al tratamiento clínico maximizado (NYHA IV), necesitando intervenciones especializadas e intensivas. El diagnóstico de la enfermedad de Chagas depende en gran medida de la fase clínica en que se encuentre el paciente. En la fase aguda de la enfermedad, en la forma congénita y en la reactivación durante la fase crónica (fundamentalmente en situaciones de inmunosupresión), la parasitemia es elevada, por lo que el diagnóstico se basa en la detección del parásito por métodos directos en sangre periférica y, de manera excepcional, en otros fluidos corporales como el líquido cefalorraquídeo4 . La microscopia directa de sangre periférica en fresco permite visualizar al parásito (tripomastigote) en movimiento. También se pueden realizar diferentes tinciones (por ej. Giemsa) sobre extensión periférica o gota gruesa de sangre periférica. La sensibilidad se puede incrementar mediante técnicas de concentración, como son el microhematocrito o el método de Strout. Otras técnicas cada vez más en desuso incluyen el hemocultivo y el xenodiagnóstico, técnicas que están solo disponibles en laboratorios especializados y que se emplean para investigación5 . En la fase crónica de la enfermedad la parasitemia disminuye drásticamente, por lo que el diagnóstico se basa en la detección de anticuerpos IgG anti-T. cruzi (diagnóstico serológico), ya que los métodos parasitológicos directos suelen ser negativos en un 30% a 60% de los pacientes. Las técnicas serológicas utilizan como antígenos tanto el parásito completo o extractos purificados (pruebas convencionales), como antígenos recombinantes o péptidos sintéticos (pruebas no convencionales). Las técnicas más empleadas son la inmunofluorescencia indirecta (IFI), la hemoaglutinación indirecta (HAI) y el enzimoinmunoanálisis (ELISA), siendo esta última la que alcanza valores óptimos de sensibilidad y especificidad6 . Sin embargo, dado que ninguna de las pruebas alcanza un 100% de sensibilidad y especificidad, la OMS define el diagnóstico de infección de Chagas en su fase crónica mediante la positividad de 2 pruebas serológicas realizadas por métodos diferentes6 . En caso de discordancia, se deberá realizar una tercera prueba para confirmar o descartar la infección7 . En las últimas décadas, la detección de ADN de T. cruzi en sangre periférica mediante la reacción en cadena de la polimerasa (PCR) se ha utilizado cada vez más. Las dianas más utilizadas son la región variable del ADN del minicírculo del kinetoplasto, secuencias repetidas en el ADN satélite o genes del ARN ribosomal8 . En la fase aguda de la enfermedad o en la reactivación durante la fase crónica ha resultado ser de gran utilidad, ya que tiene una sensibilidad mayor que las técnicas parasitológicas clásicas y de detección temprana9 . En nuestro país, la técnica validada nacional e internacionalmente es la técnica molecular por detección de fragmento de secuencia satélite de genoma de Trypanosoma cruzi por PCR en Tiempo Real dúplex usando sondas TaqMan10. El papel de la PCR en la fase crónica de la enfermedad de Chagas está más discutido, ya que resulta positiva en el 40-70% de los pacientes dependiendo de los estudios, con una gran variabilidad dependiendo de diferentes factores: el grado de parasitemia del paciente, el volumen y procesado de la muestra, la diana de la técnica, las características de la población en la que se realiza. Por otro lado, un resultado negativo no excluye la infección11. La PCR está siendo cada vez más utilizada para monitorizar la eficacia del tratamiento y para la evaluación de nuevos tratamientos en ensayos clínicos, ya que la positividad de la técnica tras la finalización del tratamiento indicaría un fracaso terapéutico12-14.
Inmunosupresión y Chagas
Con el progresivo desarrollo económico y las mejoras paulatinas de las condiciones de vida, las personas afectadas por la enfermedad de Chagas han experimentado una mayor esperanza de vida, un mejor acceso a los sistemas de salud y una coexistencia con otras enfermedades crónicas y por ejemplo estados de inmunosupresión (como virus de la inmunodeficiencia humana [VIH], tratamientos citostáticos, etc.)15. Es probable que estos factores acaben modulando la expresividad clínica de la enfermedad. De esta manera la inmunosupresión, dependiendo de la intensidad de la misma, puede modificar la historia natural de la enfermedad, facilitando la reactivación y la progresión hacia estadios avanzados durante la fase crónica. Esta situación suele cursar con una elevada parasitemia y con cuadros clínicos graves, como son la afectación del sistema nervioso central (en forma de meningoencefalitis o absceso cerebral) o miocarditis, y lesiones cutáneas paniculitis y nódulos subcutáneos, peritonitis o cervicitis. Estos cuadros graves se han descrito fundamentalmente en los pacientes con infección por el virus de la inmunodeficiencia humana (VIH) y en los receptores de trasplante, tanto hematológico como de órgano sólido y en pacientes que reciben drogas inmunosupresoras16-18. La reactivación suele ser asintomática y debido a los métodos de vigilancia con Strout y/o PCR seriados, es posible evitar la aparición de la enfermedad al instaurarse tratamiento con Benznidazol o Nifurtimox por 2 meses. De esta forma se evita la reactivación sintomática, que conlleva elevada mortalidad19. La reactivación puede ser entonces: asintomática con solo un aumento de parasitemia por técnicas parasitológicas o de biología molecular, o puede ser sintomática con afectación orgánica, como miocarditis o meningoencefalitis17. Gracias a los métodos de vigilancia con Strout y/o PCR seriados es posible evitar la aparición de la enfermedad al instaurarse tratamiento con Benznidazol o Nifurtimox por 2 meses. De esta forma se evita la reactivación sintomática, que conlleva elevada mortalidad. Podemos resumir la reactivación en: 1) Reactivación Asintomática: con parasitemia positiva, detectada por técnica de Strout o biología molecular para carga de ADN de Trypanosoma cruzi (PCR). 2) Reactivación Sintomática con manifestaciones clínicas: ● Síndrome febril inespecífico con parasitemia positiva ● Dermatológicas: eritema nodoso o paniculitis con biopsia con evidencia de tripomastigotes ● Neurológicas: encefalitis o lesión de masa ocupante o Chagoma: con LCR o biopsia con tripomastigotes ● Cardíacas: miocarditis. En nuestro país existen guías de recomendaciones conjuntas de la Sociedad Argentina de Infectología y de la Sociedad Argentina de Reumatología20 así como en los Lineamientos básicos del tratamiento etiológico de enfermedad de Chagas7,21 como otras nacionales e internacionales22-24 para el estudio, seguimiento y manejo de los pacientes inmunosuprimidos con enfermedades reumatológicas y Chagas. Estas guías recomiendan el seguimiento, preferentemente con técnicas moleculares en este grupo de pacientes, pues se adelanta en aproximadamente 2 meses al Strout. Lo que fehacientemente no se conoce es la tasa de reactivaciones, si este número es significativo y el impacto que esto tiene en el contexto de las enfermedades reumáticas. En las guías de recomendaciones nombradas, de la Sociedad Argentina de Infectología y la Sociedad Argentina de Reumatología20, formando parte de la práctica habitual desde el 2014, el médico debe solicitar al menos dos estudios serológicos para Chagas, uno de los cuales debería ser ELISA. Si ambos son positivos se realiza el diagnóstico de infección de Chagas, y se debe comenzar el seguimiento periódico recomendado si el paciente va a ser tratado con inmunosupresores. Si ambos son negativos se descarta la infección de Chagas. Si solo uno es positivo se utilizará un tercer método para definir. Para el caso de la detección precoz y el seguimiento de las reactivaciones de la enfermedad de Chagas en huéspedes inmunocomprometidos, existen recomendaciones de la Sociedad Argentina de Infectología, que sugieren en el paciente asintomático un seguimiento semanal durante los primeros 60 días, quincenal del día 61 al 6to mes, y luego mensual hasta el año con técnicas de diagnóstico directas (Strout o PCR). Para el caso de los pacientes reumatológicos bajo tratamiento inmunosupresor se estima que un esquema de seguimiento periódico sería lo recomendable. En caso de presentar síntomas en pacientes inmunosuprimidos, el diagnóstico también se realiza en forma directa a través de la pesquisa de parasitemia o mediante la detección del parásito en muestras biológicas25-27. En resumen, la enfermedad de Chagas es altamente prevalente en nuestra población, y se ha demostrado que la inmunosupresión puede reactivarla. No se conoce en qué medida la inmunosupresión utilizada en las enfermedades reumáticas, y las nuevas terapias biológicas, pueden producir esta reactivación. Mientras esperamos investigaciones que nos puedan aclarar este concepto, los reumatólogos, infectólogos y médicos en general, debiéramos estar atentos a esta posibilidad, y seguir las recomendaciones mencionadas en cuanto a tamizaje de nuestros pacientes, y seguimiento de los casos positivos.
D. Scublinsky1,2, M.V. Pinoni2, F. Ibelli2, A. Valledor3, E.R. Soriano1
1Sociedad Argentina de Reumatología.
2Primera Cátedra de Farmacología, Facultad de Medicina, UBA.
3Sociedad Argentina de Infectología. Comisión de huéspedes inmunocomprometidos.
Para descargar la investigación completa haga clik a continuación:
http://revistasar.org.ar/revistas/2019/n1/3_actualizacion.pdf