Riesgo de cáncer cutáneo asociado a terapias modificadoras de la enfermedad en la esclerosis múltiple: revisión narrativa de la evidencia actual
- ComiteNetMD
- 4 de octubre de 2024
- Dermatología, Oncología Médica
- 0 Comments
Resumen
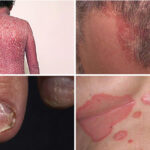
Los fármacos modificadores de la esclerosis múltiple (FAME) han supuesto un cambio en el manejo de esta enfermedad. Algunos estudios sugieren un incremento en la incidencia de cáncer cutáneo (CC) asociado a estos medicamentos. Mediante búsquedas bibliográficas en Medline y Google Scholar, hemos realizado una revisión narrativa para esclarecer el riesgo de CC asociado a los FAME. Los moduladores del receptor de la esfingosina 1-fosfato, como el fingolimod y el siponimod, asocian mayor riesgo de carcinoma basocelular (CBC), pero no de carcinoma escamoso cutáneo (CEC) ni de melanoma. Los mecanismos fisiopatogénicos no se comprenden por completo. El alemtuzumab y la cladribina presentan asociaciones aisladas con el CC. En el resto de FAME, no hemos encontrado un incremento del riesgo. Con base en la evidencia disponible, es crucial promover las evaluaciones dermatológicas necesarias adaptadas al perfil de riesgo de cada paciente. No obstante, se requieren estudios prospectivos adicionales para establecer protocolos de seguimiento dermatológico eficientes.
Introducción
La esclerosis múltiple (EM) es una enfermedad inflamatoria, desmielinizante, degenerativa y progresiva, de naturaleza autoinmune, que afecta al sistema nervioso central (SNC). Es la enfermedad neurológica crónica más frecuente en adultos jóvenes, y ocasiona consecuencias devastadoras1–5. Dado que no existe tratamiento curativo para la EM, el objetivo terapéutico consiste en controlar la actividad inflamatoria y reducir la frecuencia de los brotes, así como enlentecer la progresión de la enfermedad y su discapacidad acumulada4,5. Para conseguir este objetivo, es necesario el uso de fármacos capaces de modificar el curso natural de la EM. Estos agentes reciben el nombre de «fármacos modificadores de la enfermedad» (FAME) y han supuesto un cambio en el manejo de la EM3–8. El número de medicamentos disponibles en este grupo se ha ampliado en los últimos años, con la aprobación de nuevos moduladores del receptor de la esfingosina 1-fosfato (S1PR), y nuevos anticuerpos monoclonales (tabla 1)3–5,8–10.
Tabla 1.
Fármacos modificadores de la enfermedad (FAME) aprobados por la European Medicines Agency (EMA) para el manejo de la esclerosis múltiple y su mecanismo de acción
| FAME (año de aprobación)9,11,39 | Mecanismo de acción |
| Dimetilfumarato (2014) | Mecanismo no del todo esclarecido. Se trata de un éster del ácido fumárico, que promueve la transcripción del factor nuclear Nrf2. Esto desencadenaría la activación de un sistema de defensa celular ante estímulos tóxicos como pueden ser el estado inflamatorio y el estrés oxidativo, ambos presentes en la EM. No se considera que tenga un efecto inmunosupresor, sino que consigue modular la respuesta de las células del sistema inmune tanto a nivel periférico, como central |
| Teriflunomida (2013) | Fármaco que inhibe de forma selectiva y reversible la enzima mitocondrial dehidroorotato-deshidrogenasa, inhibiendo la síntesis de pirimidinas. Como consecuencia, bloquea la activación y proliferación de linfocitos |
| Acetato de glatirámero (2004) | Mecanismo no del todo esclarecido. Entre sus efectos propuestos destacan; unión a moléculas del complejo principal de histocompatibilidad e inhibe la activación de células T frente a antígenos de la mielina; inducción de linfocitos T Helper 2 supresores específicos |
| Interferones ββ-1a (1997)β-1b (1995)β-1a pegilado (2014) | Mecanismo no del todo conocido. Entre sus efectos propuestos destacan; control de la secreción de citocinas pro y antiinflamatorias, supresión de la activación de células T, induce la diferenciación de células madre neurales a oligodendrocitos, prevención de la migración de células del sistema inmune activadas a sangre periférica |
| Cladribina (2017) | Análogo sintético de las purinas que resulta citotóxico para los linfocitos, monocitos y células hematopoyéticas |
| Mitoxantrona (1996) | Inhibidor de la topoisomerasa II. Interrumpe la síntesis y reparación del ADN |
| Fingolimod (2011) | Moduladores del receptor de la esfingosina 1-fosfato. Las moléculas son similares a la esfingosina 1-fosfato, por lo que compiten para ocupar el receptor. Se comportan como antagonistas funcionales. Este efecto evita la migración de los linfocitos desde los ganglios linfáticos al sistema nervioso central |
| Siponimod (2020) | |
| Ozanimod (2020) | |
| Ponesimod (2021) | |
| Alemtuzumab (2013) | Anticuerpo monoclonal humanizado antiCD52. Provoca una disminución de la cifra de linfocitos T y B circulantes |
| Ocrelizumab | Anticuerpo monoclonal humanizado antiCD20. Provoca un efecto inmunomodulador a través de la reducción del número y función de linfocitos CD20 |
| Ofatumumab (2021) | |
| Natalizumab (2006) | Anticuerpo monoclonal humanizado que ejerce su función inhibiendo selectivamente la subunidad alfa-4-beta-1 de las integrinas humanas. Mediante este mecanismo, consigue evitar la migración de células inflamatorias, principalmente de los monocitos, fuera del torrente sanguíneo |
EM: esclerosis múltiple; FAME: fármacos modificadores de la esclerosis múltiple.
M. Brufau-Cochsa, M. Mansilla-Polob,c, D. Morgado-Carrascoa,d,
a Servicio de Dermatología, Hospital Clínic de Barcelona, Universitat de Barcelona, Barcelona, España
b Servicio de Dermatología, Hospital Universitario y Politécnico La Fe, Valencia, España
c Instituto de Investigación Sanitaria (IIS) La Fe, Valencia, España
d Servicio de Dermatología, Hospital de Figueres, Fundació Salut Empordá, Figueres, Girona, España
Para descargar la investigación completa haga clik a continuación:
https://www.actasdermo.org/es-riesgo-cancer-cutaneo-asociado-terapias-articulo-S0001731024000553