La FDA permite la comercialización de sistema de estimulación magnética transcraneal para el tratamiento del trastorno obsesivo-compulsivo
- netmd
- 4 de septiembre de 2018
- Psiquiatría
- 0 Comments
Agosto 17, 2018
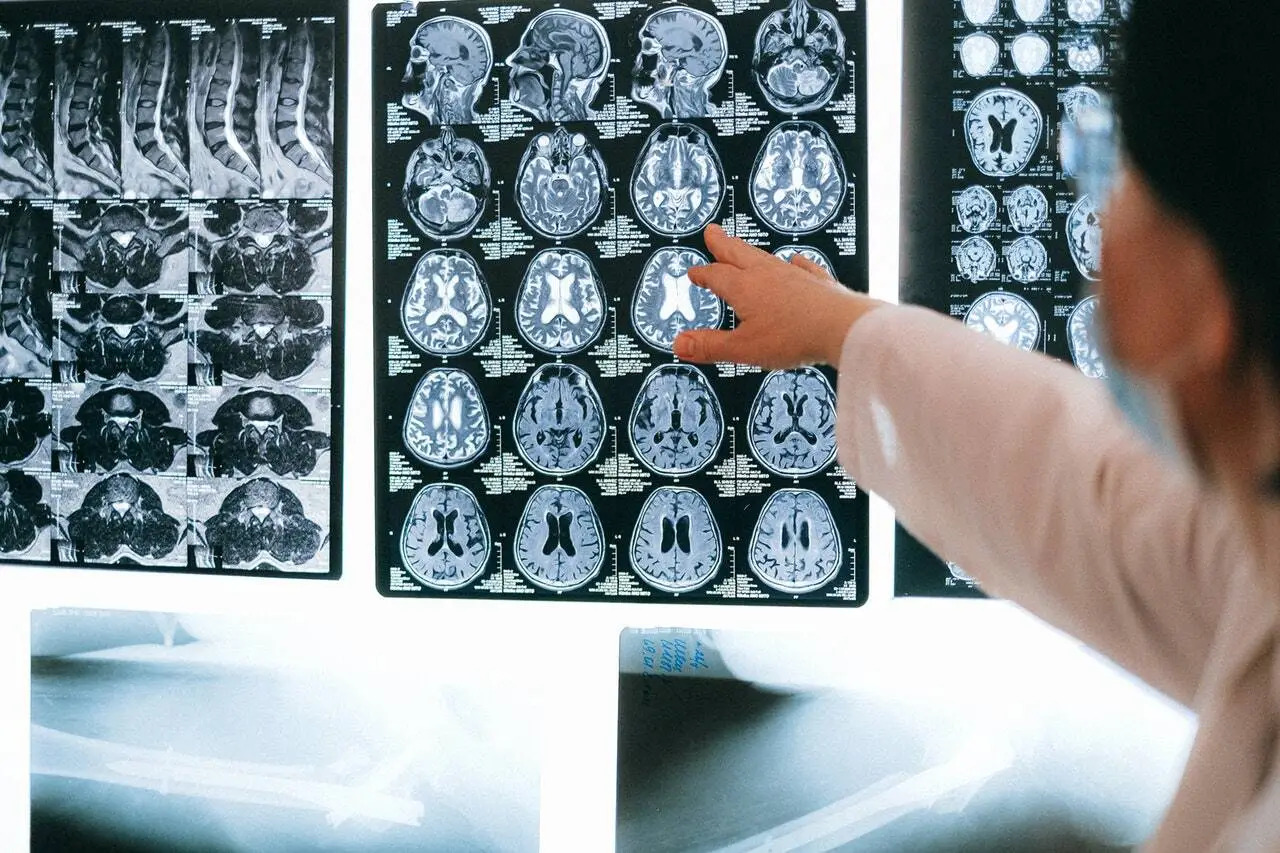
El día de hoy, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) permitió la comercialización del Sistema de Estimulación Magnética Transcraneal Profunda Brainsway para el tratamiento del trastorno obsesivo-compulsivo (TOC).
“La estimulación magnética transcraneal ha demostrado su potencial para ayudar a los pacientes que sufren de depresión y dolores de cabeza”, afirmó el Dr. Carlos Peña, PhD, M.S., director de la Sección de Dispositivos Neurológicos y de Medicina Física del Centro de Dispositivos y Salud Radiológica de la FDA. “Con la autorización para la comercialización anunciada el día de hoy, los pacientes con TOC que no han respondido a los tratamientos tradicionales ahora tienen otra opción”.
El TOC es un trastorno crónico común y duradero, en el cual una persona tiene pensamientos y comportamientos incontrolables y recurrentes que una persona siente la necesidad de repetir una y otra vez. Por lo general, el TOC es tratado con medicamentos, psicoterapia o una combinación de ambos. Según el Instituto Nacional de la Salud Mental, alrededor del 1 por ciento de los adultos estadounidenses padecieron TOC en el último año. Aunque la mayoría de los pacientes con TOC responden al tratamiento, algunos continúan experimentando síntomas.
La estimulación magnética transcraneal (EMT) es un procedimiento que utiliza campos magnéticos para estimular las células nerviosas del cerebro. La FDA permitió la comercialización de la EMT como un tratamiento para la depresión profunda en 2008, y amplió su uso para incluir el tratamiento del dolor relacionado con ciertos dolores de cabeza por migraña en 2013.
La FDA analizó los datos de un estudio aleatorio realizado en varios centros con 100 pacientes, de los cuales, 49 recibieron tratamiento con el dispositivo Brainsway y 51 con uno no activado (simulado). A los pacientes que ya recibían tratamientos (médicos) para el TOC se les mantuvo con sus dosis corrientes durante todo el estudio. El estudio evaluó la reducción en la puntuación de los pacientes en la Escala Yale-Brown para el Trastorno Obsesivo-Compulsivo (YBOC), una métrica común para medir la gravedad del TOC de un paciente. Los resultados indicaron que 38 por ciento de los pacientes respondió al dispositivo Brainsway (es decir, presentaron una reducción de más del 30% en la puntuación de la YBOC), en tanto que 11 por ciento respondió con el uso del dispositivo simulado.
La reacción adversa más frecuente fue dolor de cabeza, de la que informó 37.5 por ciento de los pacientes que recibieron el dispositivo Brainsway y 35.3 por ciento de los que recibieron el tratamiento simulado. No se informó de ninguna reacción adversa grave relacionada con el dispositivo Brainsway. Otras reacciones adversas, tales como dolor o molestias en el lugar de la aplicación, dolor de mandíbula, dolor facial, dolor muscular, espasmos o fasciculaciones y dolor de cuello, fueron descritas como leves o moderadas y desaparecieron poco después del tratamiento.
El dispositivo Brainsway está contraindicado para los pacientes con objetos metálicos o dispositivos de estimulación implantados en la cabeza o cerca de ella, incluyendo implantes cocleares, estimuladores cerebrales profundos, estimuladores del nervio vago, otros electrodos o estimuladores implantados, clips o espirales neurovasculares, estents, fragmentos de bala, joyas y pasadores para el cabello. Durante el tratamiento con el dispositivo, el paciente debe usar tapones para los oídos a fin de reducir la exposición a los fuertes sonidos que éste produce. Los pacientes que tienen antecedentes de convulsiones deben informárselo a su médico antes de recibir el dispositivo.
La FDA evaluó el dispositivo Brainsway a través de la vía de novo de evaluación previa a la comercialización, un medio para controlar algunos dispositivos que presentan un riesgo bajo a moderado y para los cuales no existe ningún otro aparato arquetipo a la venta legalmente en el mercado con el cual pueda argumentarse que tiene una equivalencia sustancial.
La FDA permitió la comercialización del dispositivo Brainsway a Brainways Ltd.
https://www.fda.gov/NewsEvents/Newsroom/ComunicadosdePrensa/ucm617620.htm