AbbVie recibe la opinión positiva del CHMP para epcoritamab (TEPKINLY®) para el tratamiento de adultos con linfoma folicular en recaída o refractario
- ComiteNetMD
- 31 de julio de 2024
- Hematología
- 0 Comments
03/07/2024
La opinión positiva del CHMP está respaldada por los resultados del ensayo clínico fase 1/2 EPCORE™ NHL-1.
AbbVie (NYSE: ABBV) ha anunciado que el Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA) ha emitido la opinión positiva en la que recomienda la autorización de comercialización de epcoritamab (TEPKINLY®), anticuerpo biespecífico de administración subcutánea que se une a los linfocitos T, como monoterapia para el tratamiento de pacientes adultos con linfoma folicular (LF) en recaída o refractario (R/R) después de dos o más líneas de tratamiento. La decisión de la Comisión Europea sobre esta indicación está prevista próximamente.
“Los pacientes con linfoma folicular suelen presentar recaídas y una menor duración de la respuesta con cada línea de tratamiento posterior. Esta opinión positiva reconoce la necesidad no cubierta en la Unión Europea para los pacientes con linfoma folicular en recaída o refractario, tras el fracaso de otros tratamientos”, declaró la Dra. Mariana Cota Stirner, vicepresidenta del área terapéutica de hematología de AbbVie.
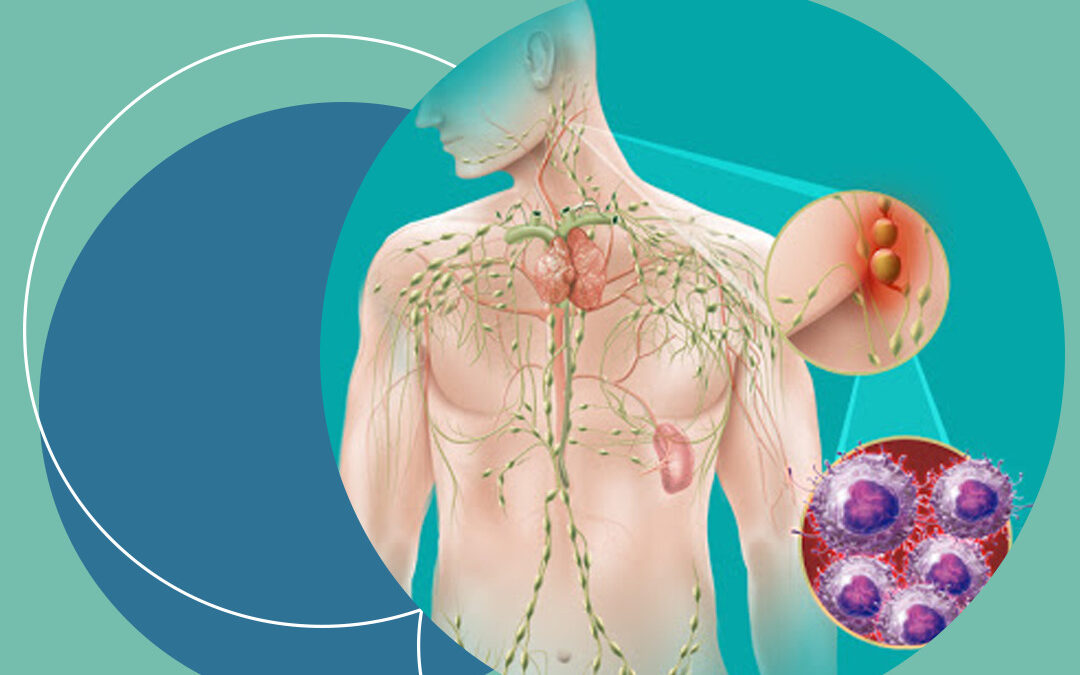
El LF es una forma de linfoma no Hodgkin (LNH) indolente, o de crecimiento lento, que se origina en los linfocitos B. Es el segundo subtipo más frecuente de LNH, y representa entre el 20% y el 30% de todos los casos de LNH en el mundo1. En 2023, había aproximadamente 13.000 casos de LF en Europa Occidental2. El LF se considera incurable con los tratamientos estándar actuales3.
La opinión del CHMP está respaldada por los datos de respuesta global y respuesta completa del ensayo clínico fase 1/2 EPCORE™ NHL-1 en 128 pacientes con LF R/R tratados con epcoritamab después de dos o más líneas de tratamiento previo. En el estudio participaron pacientes refractarios al tratamiento con anticuerpos monoclonales anti-CD20 y a un agente alquilante; pacientes refractarios al tratamiento anterior; y pacientes cuya enfermedad había progresado en los dos años siguientes al primer tratamiento sistémico. El perfil de seguridad del fármaco en la cohorte pivotal fue similar al notificado para el fármaco en monoterapia en la cohorte de pacientes con linfoma B difuso de células grandes (LBDCG) del ensayo pivotal EPCORE NHL-14.
En una cohorte adicional de 86 pacientes se evaluó un esquema de dosificación escalonado en tres pasos para reducir la incidencia y la gravedad del síndrome de liberación de citoquinas (SLC), un efecto adverso asociado a los tratamientos inmuno-oncológicos. Para la primera dosis completa de este esquema de 3 pasos no fue obligatoria la hospitalización. En esta cohorte, la incidencia de SLC fue del 49% (42 de 86 pacientes; 9% de grado 2). No se produjeron casos de SLC de grado 3 o superior. Los datos de esta cohorte de optimización del estudio EPCORE NHL-1 fueron publicados recientemente en la revista Lancet Haematology.
“Cada año se diagnostican en Europa miles de casos de linfoma folicular, siendo una triste realidad que muchas de estas personas tendrán recaídas y enfermedad refractaria”, afirmó la Dra. Catherine Thieblemont, jefa del departamento de hematooncología de la Universidad de París, Hôpital Saint-Louis Assistance-Publique-Hopitaux de Paris (APHP). “Los pacientes merecen nuevas opciones de tratamiento, y esta opinión positiva es el primer paso para llevar este tratamiento a más pacientes que lo necesitan”.
El fármaco está siendo desarrollado conjuntamente por AbbVie y Genmab como parte de la colaboración de estas empresas en el campo hematooncológico. Ambas empresas comparten responsabilidades comerciales en Estados Unidos y Japón, mientras que AbbVie se encarga de la comercialización en el resto del mundo.
Acerca del ensayo clínico fase 1/2 EPCORE NHL-1
EPCORE™ LNH-1 es un ensayo clínico abierto y multicéntrico para evaluar la seguridad y la eficacia preliminar del fármaco, que incluye tres partes: una parte de escalado de dosis; una parte de ampliación y una parte de optimización. Este ensayo se diseñó para evaluar el uso del medicamento subcutáneo en pacientes adultos con linfoma no Hodgkin (LNH) de células B maduras CD20+ en recaída, progresivo o refractario, incluyendo el linfoma folicular (LF). En la parte de ampliación se incluyeron más pacientes para investigar más la seguridad y la eficacia de la molécula en tres cohortes de pacientes con diferentes tipos de LNH de linfocitos B en recaída o refractario (R/R) que disponen de pocas opciones terapéuticas. La parte de optimización de dosis evalúa la posibilidad de utilizar pautas posológicas escalonadas alternativas para ayudar a reducir aún más el síndrome de liberación de citocinas (SLC) de grado 2 y a mitigar el SLC de grado ≥3. El objetivo principal de la parte de ampliación fue la tasa de respuesta global, determinada por un comité de evaluación independiente. Los objetivos secundarios de eficacia fueron la duración de la respuesta, la tasa de respuesta completa, la duración de la respuesta completa, la supervivencia libre de progresión y el tiempo hasta la respuesta determinado por los criterios de Lugano. La supervivencia global, el tiempo hasta el siguiente tratamiento y la tasa de negatividad de enfermedad mínima residual se evaluaron como objetivos secundarios de eficacia. El objetivo principal de la parte de optimización fue la tasa de acontecimientos de SLC de grado ≥ 2 y de acontecimientos de SLC de cualquier grado desde la primera dosis hasta 7 días después de la administración de la segunda dosis completa del tratamiento.
Los resultados preliminares del estudio se compartieron en diciembre de 2023. Puede encontrar más información en www.clinicaltrials.gov (NCT03625037).
Acerca del linfoma folicular (LF)
El LF es una forma de linfoma no Hodgkin (LNH) indolente (o de crecimiento lento), que se origina en los linfocitos B. Es el segundo tipo más frecuente de LNH, que representa aproximadamente entre el 20% y el 30% de todos los casos1. El LF se considera incurable con los tratamientos estándar actuales3. Los pacientes suelen tener recaídas y, con cada recaída, la remisión y el tiempo hasta el siguiente tratamiento son más breves5. Con el tiempo, puede convertirse en un linfoma difuso de células B grandes (LBDCG), una forma agresiva de LNH asociada a unas bajas tasas de supervivencia. Esto puede ocurren en más del 25% de los pacientes con LF6.
Acerca de epcoritamab
Es un anticuerpo IgG1 biespecífico experimental, creado con la tecnología DuoBody® patentada por Genmab y administrado por vía subcutánea. La tecnología DuoBody CD3 de Genmab está diseñada para dirigir los linfocitos T citotóxicos de forma selectiva con el fin de generar una respuesta inmunitaria contra los tipos de células diana. Se ha diseñado para unirse simultáneamente a CD3 en los linfocitos T y a CD20 en los linfocitos B e inducir la destrucción de células CD20+ mediada por los linfocitos T7.
Ha recibido la aprobación de las autoridades regulatorias para ciertos tipos de linfoma en varios países.
AbbVie seguirá presentando solicitudes de registro en mercados internacionales. Genmab y AbbVie, ambas compañías, siguen evaluando su uso, tanto en monoterapia como en combinación, en diversas líneas de tratamiento de varias neoplasias hematológicas malignas. Visite clinicaltrials.gov para obtener más información.
Acerca de AbbVie en oncología
En AbbVie tenemos la firme intención de transformar los tratamientos de referencia para varios cánceres de la sangre, haciendo avanzar al mismo tiempo una cartera dinámica de tratamientos experimentales contra diversos tipos de cáncer. Nuestro equipo especializado y experimentado aúna fuerzas con socios innovadores para acelerar la presentación de medicamentos potencialmente innovadores. Estamos evaluando más de 20 medicamentos experimentales en más de 300 ensayos clínicos para tratar algunos de los cánceres más debilitantes y extendidos por todo el mundo. Además de trabajar con el objetivo de ejercer un efecto notable en la vida de las personas, nos dedicamos a investigar soluciones que ayuden a los pacientes a acceder a nuestros medicamentos contra el cáncer. Para más información, visite http://www.abbvie.com/oncology.