Esperanza para los pacientes con ASMD: llega el primer tratamiento específico para esta enfermedad ultra-rara
- ComiteNetMD
- 31 de julio de 2024
- Endocrinología y Diabetes
- 0 Comments
04/07/2024
Xenpozyme® es una nueva terapia para tratar síntomas del déficit de esfingomielinasa ácida (ASMD) en pacientes pediátricos y adultos.
Las varias decenas de personas afectadas por el déficit de esfingomielinasa ácida (ASMD) de España ya disponen del primer y único tratamiento específco para su enfermedad ultra-rara. Se trata de Xenpozyme® (olipudasa alfa), que ha recibido la aprobación de financiación por parte del Ministerio de Sanidad para el tratamiento de pacientes pediátricos y adultos con ASMD tipo A/B o ASMD tipo B. Se trata de un hito histórico para la comunidad en torno a las enfermedades raras de nuestro país; especialmente teniendo en cuenta que esta patología genética, además de ser progresiva y potencialmente mortal, se caracteriza por condicionar de forma significativa la calidad de vida de los afectados.
El fármaco, desarrollado por Sanofi, supone un nuevo paradigma en el abordaje de la enfermedad en nuestro país: si hasta la fecha las opciones terapéuticas para el ASMD se limitaban a cuidados sintomáticos y de apoyo, este tratamiento aporta mejoras significativas en su sintomatología. Principalmente una mejora clínicamente relevante de la función pulmonar y la reducción de la hepatoesplenomegalia (agrandamiento de bazo e hígado), además de una mayor esperanza de vida. Así lo han evidenciado los ensayos clínicos ASCEND y ASCEND-Peds, en los cuales España desempeñó un papel crucial al incluir el mayor número de pacientes a nivel europeo. Estas investigaciones también constataron un buen perfil de seguridad.
Dra. Montserrat Morales
Coordinadora de la Unidad de Adultos de Enfermedades Raras y Errores Congénitos del Metabolismo del Hospital Universitario 12 de Octubre (Madrid)
“La disponibilidad de Xenpozyme® en España marca un hito significativo para pacientes con ASMD, quienes hasta ahora carecían de opciones terapéuticas específicas, limitándose a tratamientos sintomáticos. Este tratamiento promete revertir en gran medida los efectos de la enfermedad, mejorando sustancialmente su calidad de vida al reducir síntomas como astenia, intolerancia al ejercicio y fatiga. Asimismo, podría transformar el pronóstico a largo plazo de los pacientes adultos con ASMD, mejorando aspectos críticos e incapacitantes como la afectación pulmonar, la hepatoesplenomegalia, la dislipemia y las citopenias, que tradicionalmente acortaban su esperanza de vida. Además, se anticipa que estos avances terapéuticos también reducirán el riesgo cardiovascular, ofreciendo una nueva esperanza para quienes viven con esta enfermedad devastadora”.
Olipudasa alfa está indicado tanto para pacientes adultos como para pediátricos con ASMD de tipos B y A/B, a quienes los citados ensayos clínicos han evidenciado que consigue cambiar su pronóstico al evitar la progresión de la enfermedad.
Dr. Antonio González-Meneses López
Pediatra especialista en enfermedades raras de causa genética en el Hospital Universitario Virgen del Rocío (Sevilla)
“El tratamiento va a tener un impacto importantísimo en los niños afectados por ASMD tipo B, ya que mejora la enfermedad desde los primeros meses de administración: evitando su progresión, mejorando sus síntomas y, lo más importante, aumentando su esperanza de vida. Los ensayos clínicos han demostrado beneficios significativos, como la reducción evidente de la hepatoesplenomegalia, la mejora pulmonar y ósea, y una disminución de los niveles de lisoesfingomielina tanto a corto como a largo plazo. Los pacientes muestran una notable mejoría en su capacidad para realizar actividades diarias con menor cansancio y mayor energía, evitando complicaciones a largo plazo y reduciendo la mortalidad precoz. Este avance ofrece una esperanza renovada para los pacientes y sus familias”.
La luz verde de la Comisión Interministerial de Precios de los Medicamentos (CIMP) para las manifestaciones no relacionadas con el sistema nervioso central (SNC) en pacientes con ASMD tipo A/B o ASMD tipo B llega casi dos años después que la Comisión Europa (CE) autorizara olipudasa alfa con la designación de PRIority MEdicines (PRIME) por las necesidades médicas no cubiertas.
Un tratamiento primero en su clase
El nuevo fármaco es el ejemplo más reciente de la apuesta de Sanofi por la investigación y desarrollo de moléculas first-in-class y best-in-class para el tratamiento de enfermedades raras (EERR).
Raquel Tapia
Directora general de Sanofi Iberia
“Xenpozyme® es mucho más que el primer y único tratamiento específico para el ASMD, ya que supone un cambio radical en el día a día de los afectados y, sobre todo, mejora de la reducción de la esperanza de vida de hasta literalmente la mitad, según los estudios. Algo que nos hace sentir muy orgullosos, ya que pone de manifiesto que nuestro compromiso con la I+D de tratamientos first y/o best-in-class que permitan mejorar la vida de las personas con enfermedades raras es real. A modo de ejemplo, en la actualidad el 14% de todos los proyectos en investigación que la Compañía tiene en marcha en el mundo son para enfermedades minoritarias, lo que nos mantiene como referentes mundiales en este campo”.
La Compañía fue pionera en el mundo y en España en desarrollar un tratamiento para una enfermedad rara de depósito lisosomal, en concreto para la enfermedad de Gaucher. Fue además la primera terapia de reemplazo enzimático, el mismo tipo de tratamiento innovador que es Xenpozyme®.
Con este nuevo fármaco, son ya ocho las terapias para trastornos poco frecuentes – lisosomales y hematológicos- que la biofarmacéutica pone a disposición de la comunidad española en torno a las EERR; lo que refuerza su compromiso con esta área.
Sobre el ASMD1
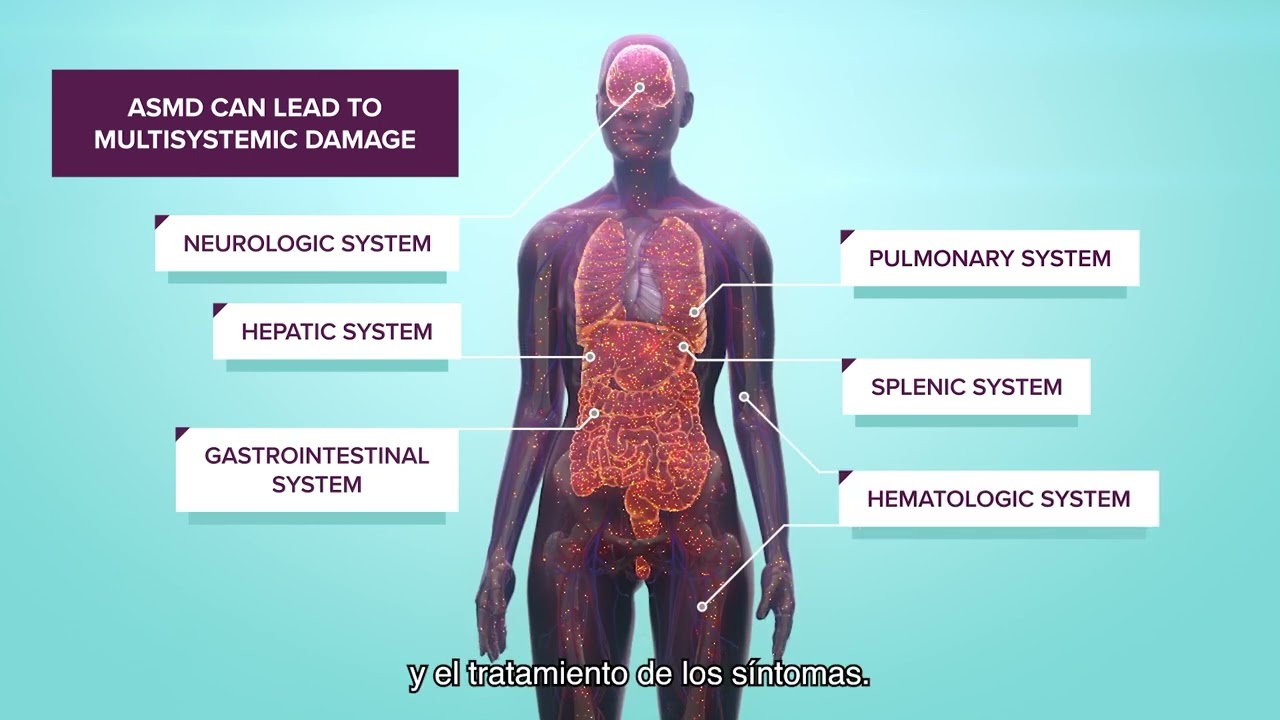
Históricamente conocida como enfermedad de Niemann-Pick tipos A, A/B y B, el ASMD (acrónimo de Acid Sphingomyelinase Decifiency) o déficit de esfingomielinasa ácida es una enfermedad ultra-rara de origen genético, progresiva y potencialmente fatal. Forma parte del grupo de enfermedades de depósito lisosomal -o lisosomales- y se caracteriza por la falta de la enzima esfingomielinasa ácida (ASM), la cual permite la descomposición de la esfingomielina lipídica. Una cantidad insuficiente de la enzima ASM implica que la esfingomielina está mal metabolizada, lo que podría ocasionar una acumulación de por vida en múltiples órganos (pulmón, hígado o bazo, entre otros), causando su mal funcionamiento.
Estas complicaciones pueden afectar significativamente la calidad de vida de los pacientes, limitando su capacidad para realizar actividades cotidianas y, en los casos más graves, llevándolos a una situación de discapacidad o, en última instancia, provocándoles la muerte prematura2-4.
El ASMD engloba dos tipos que pueden suponer extremos opuestos: ASMD tipo A y ASMD tipo B. La primera forma es más grave porque implica afectación neurológica progresiva, además de afectación multiorgánica, y suele manifestarse los primeros meses de vida, condicionando una muerte temprana. La segunda tiene una edad de diagnóstico variable, aunque suele comenzar en la infancia tardía o la edad adulta. Por otra parte, el ASMD tipo A/B es una forma intermedia que incluye diversos grados de afectación del sistema nervioso central (SNC).
El déficit de esfingomielinasa ácida tiene una incidencia aproximada de un caso entre 250.000 nacidos vivos. Su prevalencia en España se está estudiando, aunque en este momento hay diagnosticados varias decenas de pacientes.
Sobre Xenpozyme®
Xenpozyme® (olipudasa alfa) es una terapia de reemplazo enzimático diseñada para reemplazar la función deficitaria de la enzima esfingomielinasa ácida (ASM), una enzima que permite la descomposición de la esfingomielina. La acumulación de esfingomielina en las células puede causar daño a los pulmones, el bazo y el hígado, así como a otros órganos y al sistema nervioso central, lo que potencialmente puede llevar a una muerte temprana. Xenpozyme ha sido evaluado en pacientes pediátricos y adultos para el tratamiento de las manifestaciones no relacionadas con el SNC de ASMD tipo A/B y ASMD tipo B. Xenpozyme no ha sido estudiado en pacientes con ASMD tipo A.
Durante 2022, Xenpozyme fue aprobado en Europa, Estados Unidos y Japón.