Se presenta sendas solicitudes en Estados Unidos y la Unión Europea para obtener la aprobación de DARZALEX FASPRO® y DARZALEX® (daratumumab) en monoterapia por vía subcutánea para el mieloma múltiple quiescente de alto riesgo
- ComiteNetMD
- 27 de noviembre de 2024
- Hematología
- 0 Comments
Si se aprobase, daratumumab se convertiría en la primera opción de tratamiento para pacientes con mieloma múltiple quiescente con alto riesgo de desarrollar la enfermedad.
Johnson & Johnson ha anunciado la presentación de sendas solicitudes de autorización a la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) y a la Agencia Europea de Medicamentos (EMA) para obtener la aprobación de una nueva indicación para DARZALEX FASPRO® (daratumumab y hialuronidasa-fihj) en Estados Unidos y la formulación subcutánea (SC) de DARZALEX® (daratumumab) en la Unión Europea. Estas solicitudes están respaldadas por datos del estudio fase 3 en curso AQUILA (NCT03301220) de daratumumab SC en monoterapia para el tratamiento de pacientes adultos con mieloma múltiple quiescente de alto riesgo.[1]
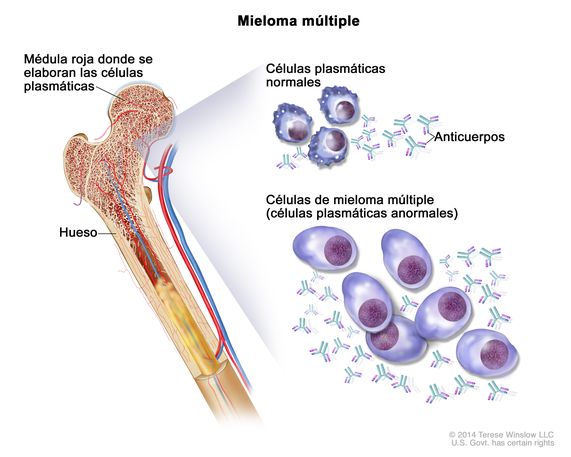
El mieloma múltiple quiescente es un precursor temprano del mieloma múltiple activo, en el que se pueden detectar células anómalas en la médula ósea. Los pacientes suelen ser asintomáticos.1 El 15% de todos los casos de mieloma múltiple recién diagnosticado se clasifican como quiescente y la mitad de los diagnosticados como mielomas quiescentes de alto riesgo progresarán a mieloma múltiple activo en dos años.[2] Actualmente, como regla general, el mieloma múltiple quiescente no se trata hasta que se desarrolle enfermedad activa y el enfoque estándar es la observación para monitorizar la enfermedad en busca de signos de progresión bioquímica y/o daño a órganos terminales para iniciar el tratamiento.1 La evidencia reciente sugiere que aquellos pacientes con alto riesgo de progresión a mieloma múltiple activo podrían beneficiarse de una intervención terapéutica más temprana.[3]
“Sigue existiendo una necesidad médica no cubierta de intervenciones y tratamientos tempranos que sean eficaces y bien tolerados en personas que viven con mieloma múltiple quiescente y con alto riesgo de progresar a mieloma múltiple activo”, ha afirmado Yusri Elsayed, jefe del Área Terapéutica Global de Oncología de Johnson & Johnson Innovative Medicine. “Este fármaco ha cambiado el estándar de tratamiento en el mieloma múltiple y, con estas solicitudes a la FDA y a la EMA, esta terapia podría convertirse en el primer tratamiento aprobado para pacientes con mieloma múltiple quiescente de alto riesgo, ayudando a cambiar el paradigma del tratamiento”.
Los primeros datos del estudio AQUILA, que evalúa el perfil de seguridad y eficacia a 3 años del tratamiento de duración fija por vía subcutánea con este tratamiento en comparación con la monitorización activa en participantes con mieloma múltiple quiescente de alto riesgo, se presentarán en la Congreso Anual de la Sociedad Americana de Hematología 2024 (ASH por sus siglas en inglés), que tendrá lugar en San Diego (EEUU) del 7 al 10 de diciembre.4