Talquetamab aporta “algo nuevo” para rescatar a los pacientes de mieloma múltiple triple expuestos
- ComiteNetMD
- 9 de diciembre de 2024
- Hematología
- 0 Comments
02/12/2024
Es un tratamiento que emplea el sistema inmune de los pacientes. Se da el pistoletazo de salida de ▼TALVEY® (talquetamab), cuyos criterios de financiación son la indicación.
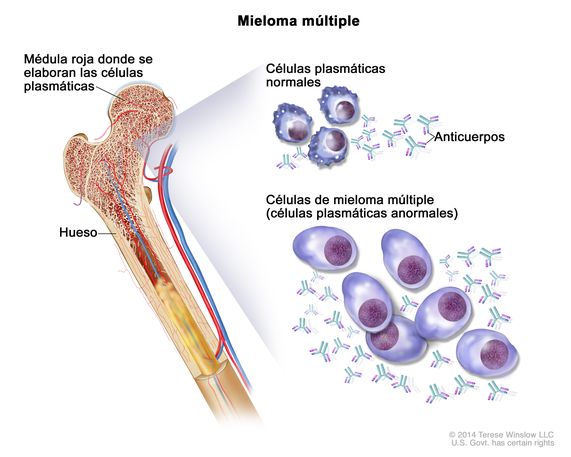
El mieloma múltiple es un cáncer de la sangre todavía hoy en día incurable. Se estima que más de 35.000 personas en la Unión Europa fueron diagnosticadas de esta patología en 2022 y más de 22.700 pacientes fallecieron. Además, estos pacientes tienden a recaer de la enfermedad pese a los tratamientos y se vuelven refractarios a los mismos, sin que exista un estándar de tratamiento.
En este contexto, Johnson & Johnson comunicó este lunes, en rueda de prensa, la llegada a España de ▼TALVEY® (talquetamab) en monoterapia para el tratamiento de pacientes adultos con mieloma múltiple en recaída y refractario. Se trata del primer y único anticuerpo biespecífico anti-GPRC5D aprobado por la Comisión Europea (CE) . Su mecanismo de acción va dirigido frente al receptor CD3 de los linfocitos T y contra el receptor GPRC5, provocando la activación de los linfocitos T y la posterior destrucción de las células del mieloma.
El objetivo era dar el pistoletazo de este fármaco indicado para su uso en pacientes con mieloma múltiple, triples expuestos. Jacobo Muñoz, director médico de Johnson & Johnson Innovative Medicine España, comentó que ésta es una enfermedad frecuente. Apuntó que hay 3.300 casos nuevos en nuestro país cada año. “Se sigue teniendo una necesidad no cubierta que cubrir. Ahí es donde aparece talquetamab, que presenta tasas de respuesta rápidas y duraderas“, afirmó. En España, ha sido ampliamente utilizado en ensayos clínicos y en programas de situaciones especiales. Con ello, se refleja la necesidad de estos pacientes de recibir terapias innovadoras. La meta del laboratorio es curar esta enfermedad, por lo que trabaja con alianzas con los pacientes, con las autoridades sanitarias, con los profesionales sanitarios, entre otros, por un frente común.
La Dra. María Victoria Mateos, hematóloga y responsable de la Unidad de Mieloma y Unidad de Ensayos Clínicos del Hospital Universitario de Salamanca, matizó que Johnson & Johnson este año es la compañía líder en hematología. De talquetamab, dijo que era un fármaco que necesitaban en pacientes con mieloma. Aclaró que la supervivencia de los pacientes está incrementándose. En el momento de la recaída, tenían una necesidad no cubierta. “No había ningún estándar. Los pacientes recibían más de 100 regímenes diferentes. Sólo uno de cada tres pacientes respondía y la supervivencia libre de progresión era muy corta, de unos cuatro meses“, declaró. Esta nueva molécula va contra el GPRC5D y utiliza el sistema inmune de los pacientes. Hay dos maneras de administrar el fármaco. La tasa global de respuesta supera el 70 %. Con los tratamientos convencionales era un 30 %. Con talquetamab se ven tasas de respuesta que superan el año y medio. A su juicio, “aporta algo más, algo nuevo, para poder rescatar a los pacientes triple expuestos“. Insistió en que es un tratamiento que emplea el sistema inmune de los pacientes. Los efectos adversos que se producen son “perfectamente manejables“. La incidencia de infecciones es menor que con otras terapias. Destacó que España ha participado en su programa clínico de desarrollo y más de 250 pacientes lo han utilizado en el programa de situaciones especiales. Para ella, el que esté disponible es una satisfacción porque supone una estrategia de tratamiento adicional a lo que ya se tenía. El que los especialistas tengan experiencia en él contribuirá a que su entrada sea más sencilla.
El hecho de que sólo a un 6 % se le haya tenido que quitar el tratamiento, por los efectos adversos, que suelen ser tolerables, es un dato muy para tener en cuenta para el Dr. Miguel Ángel Calleja, jefe de servicio de Farmacia Hospitalaria del Hospital Virgen Macarena (Sevilla) y expresidente de la Sociedad Española de Farmacia Hospitalaria (SEFH). Recordó que éste es un fármaco dirigido a pacientes que son politratados. En el aspecto de la eficiencia, remarcó que los criterios de financiación son la indicación, lo que conlleva que “el Ministerio de Sanidad apuesta por este fármaco“.
Entre 500 y 1.000 pacientes podrían ser candidatos para recibir este fármaco. Ahora mismo, pacientes que lleguen a cuarta línea de tratamiento sería un 30 % de los pacientes a los que se diagnostica.
En agosto de 2023, la Comisión Europea (CE) concedió la autorización de comercialización condicional (CMA por sus siglas en inglés) a talquetamab en monoterapia para el tratamiento de pacientes adultos con mieloma múltiple en recaída y refractario, que han recibido al menos tres tratamientos previos, incluyendo un agente inmunomodulador, un inhibidor del proteasoma y un anticuerpo anti-CD38 y han presentado progresión de la enfermedad al último tratamiento. Hoy sigue siendo el primer y único anticuerpo biespecífico anti-GPRC5D autorizado. Asimismo, la EMA ha concedido la designación de orfandad a talquetamab, siendo por ello el primer y único anticuerpo biespecífico para el tratamiento del mieloma múltiple que ha conseguido esta designación.